中药因其多组分、多靶点的特性,一直是科研领域的热点和难点。一方面,其物质基础和作用机制常让人摸不着头脑;另一方面,网络药理学虽能揭示其多途径、多靶点的治疗机制,但纯分析类文章往往面临认可度有限、验证风险大、缺乏延续性等问题。在这种背景下,如何在中药靶点及作用机制研究中脱颖而出,发表高影响因子文章?本文将为您一一剖析。
通过对2024年中科院2区多篇相关文章的梳理,我们将全方位剖析中药靶点及作用机制研究的思路与工作量,希望能为您的科研之路提供一些启发。

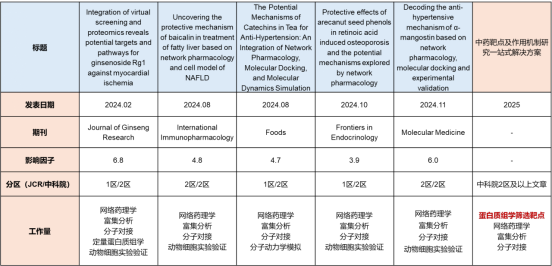
2024年2月,福建医科大学和福建农林大学团队在《Journal of Ginseng Research》(IF=6.8)发表了标题为“Integration of virtual screening and proteomics reveals potential targets and pathways for ginsenoside Rg1 against myocardial ischemia”的文章。该研究发现人参皂苷Rg1通过靶向MAPK1 和ADK,抑制氧化磷酸化(OXPHOS)通路,可有效缓解心肌细胞氧化应激损伤。
研究团队首先利用网络药理学构建了人参皂苷(Rg1)的药物成分-靶点-疾病网络;并通过功能注释富集分析,预测了Rg1抗心肌缺血(MI)的相关通路。随后,他们采用分子对接评估了Rg1与靶点蛋白的结合情况,筛选出了两种人参皂苷Rg1结合活性更强的靶蛋白:丝裂原活化蛋白激酶1(MAPK1)和腺苷激酶(ADK)。接着,通过TMT定量蛋白质组学技术,筛选出Rg1干预H2O2诱导的心肌细胞损伤模型中的差异表达蛋白(DEPs)。最后,通过动物/细胞实验验证,利用Western blot、蛋白重组和光谱分析等技术,进一步证实了腺苷激酶(ADK)为Rg1结合和调节氧化磷酸化途径的靶点(如图1)。

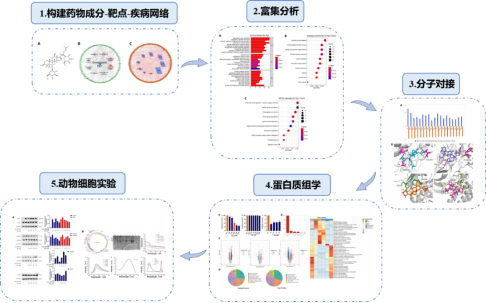
图1 研究流程
工作量盘点
1.网络药理学:通过虚拟筛选,得到121种Rg1抗心血管疾病的潜在靶点,并构建了“Rg1-靶点-疾病”网络,以及蛋白质互作网络。根据网络度值分析,筛选关键靶点。
2.富集分析:GO,KEGG和DO富集分析表明,氧化应激损伤模型适用于研究Rg1治疗心血管疾病的作用机制。
3.分子对接:使用Sybyl 1.3和AutoDock Vina对Rg1与121个潜在靶点的结合能进行评估,筛选出19种高分蛋白(总分>5.0,结合能≤-7 kcal/mol),包括PAH,MAPK1,DAPK1,MMP8,PYGL,ADK等,这些蛋白可能是Rg1的潜在结合靶点。
4.定量蛋白质组学分析:对Rg1干预H2O2损伤心肌细胞进行定量蛋白质组学分析,结果表明Rg1对缺血心肌细胞模型的保护机制可能主要涉及细胞质、细胞核和线粒体的功能。KEGG途径富集分析表明Rg1主要通过氧化磷酸化(OXPHOS)、帕金森病和阿尔茨海默病、柠檬酸循环(TCA)等信号通路发挥抗心肌缺血作用。
5.动物/细胞实验验证:检测了Rg1干预对MAPK关键蛋白及氧化磷酸化途径的影响,结果发现RG1降低了MAPK和氧化磷酸化途径的磷酸化和活化;为了证实ADK和Rg1之间确实发生了反应,进行了ADK蛋白重组和纯化,并研究了Rg1对ADK的光谱特性,结果表明ADK可以与Rg1相互作用。
2024年8月,西北农林科技大学团队在《International Immunopharmacology》(IF=4.8)发表了标题为“Uncovering the protective mechanism of baicalin in treatment of fatty liver based on network pharmacology and cell model of NAFLD”的研究论文,该研究发现黄芩苷可调节主要炎症指标和脂肪生成过程,从而预防奶牛脂肪肝的发生。
本研究首先通过网络药理学获取黄芩苷的潜在靶点和脂肪肝的疾病靶点,并构建了潜在靶点的蛋白质-蛋白质相互作用(PPI)网络。随后,对黄芩苷治疗和预防脂肪肝的潜在靶点进行了GO和KEGG功能富集分析。接着,利用分子对接技术评估黄芩苷与核心靶点的结合亲和力。最后,通过体外实验验证了黄芩苷对非酯化脂肪酸处理的奶牛肝细胞脂质积累的缓解效果,系统地揭示了黄芩素改善脂肪肝的分子机制(如图2)。

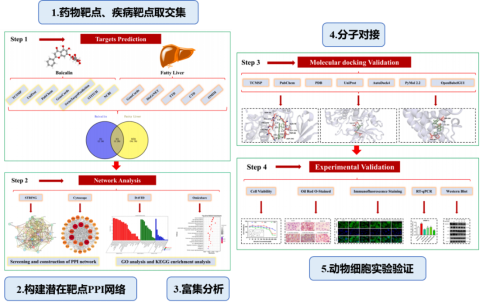
图2 研究流程
工作量盘点
1.网络药理学:黄芩苷与脂肪肝共有33个交集靶点,通过构建PPI网络和核心PPI网络,确定了前20个相关靶点。
2.富集分析:GO和KEGG富集分析表明,这些潜在靶点主要参与脂质代谢和生物合成过程,涉及胰岛素信号、TNF信号、AMPK信号等通路。
3.分子对接:分子对接结果表明,黄芩苷与AKT1、EGFR、PPARG、SLC2A4和TNF等核心靶点的结合能较强,表明黄芩苷可能通过与这些靶点相互作用,有效预防和减轻脂肪肝的发展。
4.动物/细胞实验验证:CCK-8检测结果显示,黄芩苷影响细胞活力;油红O脂肪染色和相关指标检测表明黄芩苷能减轻非酯化脂肪酸处理的牛肝细胞中的脂质积累; Western blot、荧光定量和免疫荧光实验显示黄芩苷通过抑制脂质合成和促进脂质氧化来减轻脂肪肝的发展,且黄芩苷能改善关键靶基因的表达。
儿茶素抗高血压的潜在机制:网络药理学、分子对接和分子动力学模拟的整合

2024年8月,福建农林大学团队在《Foods》(IF=4.7)发表了文章“The Potential Mechanisms of Catechins in Tea for Anti-Hypertension: An Integration of Network Pharmacology, Molecular Docking, and Molecular Dynamics Simulation”。该研究系统地阐明了儿茶素抗高血压的潜在机制,为儿茶素作为功能性添加剂在预防高血压方面的开发和应用提供了理论依据。
研究者首先从数据库获取儿茶素各成分的结构信息,预测其潜在靶点,并与高血压相关靶点取交集,筛选出关键靶点并构建蛋白-蛋白相互作用(PPI)网络。通过GO和KEGG富集分析,揭示这些靶点在血管功能调节中的多重作用。接着,对儿茶素成分和关键靶点进行了分子对接和分子动力学模拟,以揭示儿茶素治疗高血压的潜在靶点和机制,为儿茶素治疗高血压提供科学依据(如图3)。

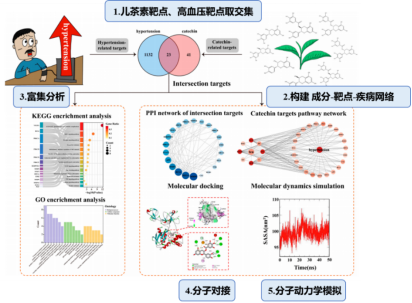
图3 研究流程
工作量盘点
1.网络药理学:首先通过SEA搜索服务器和SwissTargetPrediction数据库收集8种儿茶素成分的靶点,然后从DisGeNET、OMIM和GeneCards数据库中收集高血压相关靶点取交集,获得儿茶素治疗高血压的潜在靶点。进而建立儿茶素—靶点—高血压网络,并利用PPI网络筛选关键靶标。
2.富集分析:对23个交集靶点进行了GO和KEGG富集分析。结果表明,关键靶点在调节血管平滑肌收缩、促进血管生成和介导血管内皮生长因子受体信号传导过程中发挥重要作用。
3.分子对接:使用分子对接评估4个儿茶素成分与3个关键靶基因(MMP9、HIF1A和BCL2)的结合亲和力。结果表明,四种儿茶素成分与三个靶标的对接结合能范围为-6.2 kcal/mol至-8.9 kcal/mol,较低的对接分数表示更强的结合亲和力。
4.分子动力学模拟:对四种蛋白质-配体复合物进行了分子动力学模拟,进一步探索蛋白质-配体相互作用的稳定性。
槟榔籽酚对维甲酸诱导的骨质疏松症的保护作用及网络药理学探索的潜在机制
2024年10月,中国热带农业科学院、海南槟榔果工程技术研究中心、昆明科技大学等单位研究团队在《Frontiers in Endocrinology》(IF=3.9)发表了标题为“Protective effects of arecanut seed phenols in retinoic acid induced osteoporosis and the potential mechanisms explored by network pharmacology”的文章,该研究揭示了槟榔籽酚(ASP)治疗继发性骨质疏松症(OP)的分子机制。
本研究根据网络药理学方法,从数据库中收集与骨质疏松症相关的靶标和槟榔籽酚化合物相关的靶标,获得槟榔籽酚治疗骨质疏松症的关键靶标和活性最高的化学物质,并构建了一个药物成分-靶点-疾病网络;接着对这些潜在靶点进行了富集分析获得槟榔籽酚治疗骨质疏松症的可能相关通路;随后通过分子对接分析核心活性化学物质与关键靶标的结合能力;最终在动物实验中,验证槟榔籽酚对骨质疏松的改善效果(如图4)。
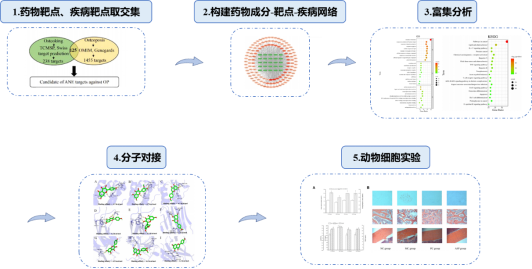

图4 研究流程
工作量盘点
1.网络药理学:从槟榔籽酚中共筛选出25种活性成分,鉴定出238个化合物相关靶点。以“骨质疏松症”为搜索词,获得疾病相关靶点。药物靶点和疾病靶点的交集被认为是槟榔籽酚缓解骨质疏松的潜在靶点,并构建药物成分-靶点-疾病网络。通过网络拓扑算法分析,确定关键成分与核心靶点。
2.富集分析:利用Metascape数据库对潜在靶点进行GO富集分析和KEGG通路富集分析,发现排名靠前的三个通路为癌症、脂质和动脉粥样硬化的通路以及白细胞介素-17(IL-17)信号通路。
3.分子对接:根据网络药理学分析结果,选择排名靠前的3个关键化合物和3个核心靶蛋白作为配体和受体进行分子对接验证。然后,通过Autodock vina软件计算结合能来评估配体与受体的结合亲和力。
4.动物/细胞实验验证:测定了所有大鼠血清中骨钙素(氰酸盐)水平和碱性磷酸酶(ALP)活性;使用骨切片染色观察槟榔籽酚影响的骨微观结构;通过显微计算机断层扫描获得骨密度(BMD)、皮质骨厚度(CBT)、骨皮质面积比(CAR)和骨小梁面积比(TAR),以评价槟榔籽酚对骨丢失的有效性。
基于网络药理学、分子对接和实验验证的α-倒捻子素抗高血压机制解码
2024年11月,上海交通大学医学院附属瑞金医院团队在《Molecular Medicine》(IF=6.0)发表了标题为“Decoding the anti-hypertensive mechanism of α-mangostin based on network pharmacology, molecular docking and experimental validation”的文章,研究发现NF、HSP90AA1、NFKB1、PPARG、SIRT1、PTGS2和RELA可能是α-MG治疗高血压的潜在靶点,为进一步研究其药理机制和临床应用奠定了基础。
研究团队首先获取α-倒捻子素的药物靶点、高血压相关靶点,取交集确定了α-倒捻子素的潜在抗高血压治疗靶点,并构建药物成分-靶点-疾病网络;接着对这些潜在靶点进行GO、KEGG富集分析寻找α-倒捻子素抗高血压的相关通路;然后通过分子对接证实了α-倒捻子素与已鉴定靶点的结合亲和力;最后通过动物/细胞实验验证α-倒捻子素的抗高血压作用(如图5)。

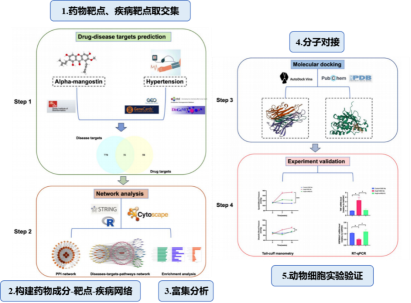
图5 研究流程
工作量盘点
1.网络药理学:使用SwissTargetPrediction数据库确定了109个α-倒捻子素(α-MG)的药物靶点,从4个数据库中获得821个疾病相关基因,取交集后得到51个α-MG治疗高血压的潜在靶点。基于51个靶点构建PPI网络,筛选出20个核心靶点。
2.富集分析:通过对51个α-MG治疗高血压的潜在靶点进行GO、KEGG富集分析,探讨靶点相关的通路,选取富集程度最高的10种通路构建疾病-靶标-功能-通路网络。
3.分子对接:通过分子对接评估α-MG与20个核心靶点的结合亲和力。结果显示,20个靶点均与α-MG有稳定结合,其中,与HSP90AA1有最强和最稳定的结合亲和力。
4.动物/细胞实验验证:建立AngⅡ输注高血压小鼠模型以评估α-MG的降压作用,结果发现,α-MG治疗可降低血压,且qPCR结果表明,α-MG治疗可以逆转Ang II诱导的靶点表达失调。
本专题精选的5篇2024年中科院2区中药方剂类药物作用机制研究文章,行文思路主要是网络药理学的方法,利用公开数据库挖掘中药方剂的活性成分及作用靶点、疾病的已知靶点,构建药物-成分-靶点-疾病的作用网络,并针对交集靶点进行生物信息学的注释,然后提取关键作用靶点基于计算机模拟做分子对接,此外挑选核心活性成分在细胞或动物层面进行功能上的验证。这个研究范式思路非常清晰,基于公开数据库挖掘、生物信息学分析和计算机模拟均可以确定性的产生大量研究结果和丰富的展示图表,细胞或动物层面的验证又避免了“纸上谈兵”的嫌疑。
但该研究范式仍然具有争议和风险的地方,文章的活性化合物、靶点及作用关系均来源于公开数据库挖掘,后期的验证也存在极大不确定性。基于此我们做了针对性优化,推出了中药靶点及作用机制一站式解决方案,方案使用自身课题实验材料利用质谱高通量技术来筛选药物作用靶点,将文章的主体从公开数据库挖掘转为实验性研究,同时来源于同批实验材料筛选的结论让验证变得更具确定性。
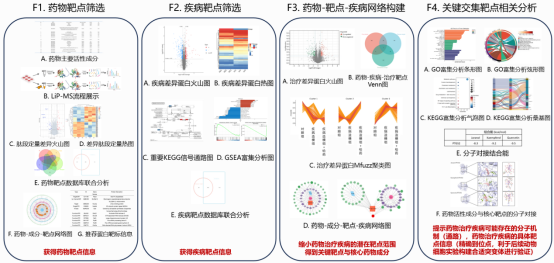
谱度众合公司为中医药领域的研究者们量身打造的中药靶点及作用机制研究一站式解决方案。在整合上述5篇中科院2区文章中网络药理学、富集分析、分子对接等传统研究方法的基础上,创新性地引入了高通量蛋白质组学技术,实现对药物靶点、疾病靶点及治疗靶点的精准筛选和作用机制的深度剖析。基于高通量无偏见筛选的数据,不仅可信度更高,还显著增强了证据的说服力,为科研成果提供了坚实的支撑。
完整版的报告包含7大分析模块以及25+项分析内容,最终交付4组核心组图和结题报告,可独立成文,满足3区文章或2区90%的工作量要求,产品整合度极高。
F1:聚焦药物靶点筛选,涵盖药物活性成分分析、LiP-MS流程展示、肽段定量差异火山图、热图及药物靶点数据库联合分析,并构建药物-成分-靶点网络图,推荐重要蛋白靶标,精准获取药物靶点信息。
F2:针对疾病靶点筛选,展示疾病差异蛋白火山图、热图、KEGG信号通路图及GSEA富集分析图,联合数据库分析锁定潜在疾病靶点。
F3:构建药物成分-靶点-疾病网络,通过治疗靶点差异蛋白火山图、靶点交集分析及MFuzz聚类图,缩小潜在靶点范围,确定关键靶点与核心药物成分。
F4:对交集关键靶点进行GO和KEGG富集分析,展示GO富集分析条形图、弦形图,以及KEGG富集分析气泡图和桑基图,并将药物关键活性成分与核心靶点进行分子对接,揭示药物作用的分子机制及具体靶点信息,助力后续实验验证。
客户仅需提供样本、药物及关注疾病信息,其余工作均交由谱度众合公司完成。我们会根据客户需求定制专属方案,从样本制备到质谱检测、数据分析,直至报告生成,全程由公司专业团队负责。此外,每个项目配备资深学术顾问和生信专家,助力中医药领域的基础研究者,做基于高通量筛选的中药靶点及作用机制研究,做实验性研究,发高水平文章!