期刊名称:
Nature Communications
影响因子:14.7
期刊分区:JCR 1区/中科院1区
发表时间:2023年11月
作者单位:中国医科大学附属医院、哈尔滨医科大学
相关疾病:上皮性卵巢癌
样本类型:卵巢上皮组织
相关产品:临床组织样本蛋白质组研究一站式解决方案
样本数量:269
其他信息:预后生物标志物、疾病进展生物标志物、治疗靶点
01.
前言
Preface
今天给大家分享一篇通过对上皮性卵巢癌进行蛋白质组学分析,发现其不同组织学亚型的分子特征并寻找预后生物标志物、疾病进展标志物及潜在治疗靶点的文章,于2023年11月发表在Nature Communications(IF=14.7)杂志上,标题为“Proteomic characterization of epithelial ovarian cancer delineates molecular signatures and therapeutic targets in distinct histological subtypes”。

02.
研究背景
Research Background
上皮性卵巢癌(EOC)是最常见的卵巢癌(OC)类型,常见组织学亚型包括透明细胞癌(CCC)、子宫内膜样癌(EC)、浆液性癌(SC)和粘液癌(MOC)。其中,浆液性癌是最普遍的上皮性卵巢癌亚型,其生存结果最差。上皮性卵巢癌占卵巢癌的50%-70%,以发病隐匿和预后不佳为特征,其致死率居妇科恶性肿瘤首位,严重威胁全球女性健康。因此,亟需通过揭示异常调控的分子通路,以识别生物标志物和潜在的药物靶点,从而对上皮性卵巢癌进行预防和治疗。
这项研究使用LFQ定量蛋白质组学分析检测了239份上皮性卵巢癌(EOC)样本以及30个对照组织(CT)样本,充分探究了上皮性卵巢癌中不同组织学亚型的分子特征和治疗靶点。基于组织学亚型的蛋白质丰度、预后情况和药物靶点方面的显著差异,筛选了潜在的预后生物标志物、疾病进展生物标志物和治疗靶点并进行了验证。该研究为了解上皮性卵巢癌不同组织学亚型的分子特征以及制定治疗策略提供了新的思路。
03.
研究样本
Research Sample
239例上皮性卵巢癌患者的卵巢上皮组织样本包括:80例透明细胞癌(CCC)样本、79例子宫内膜样癌(EC)样本、80例浆液性癌(SC)样本;以及30例对照组织(CT)样本。所使用的样本均为福尔马林固定石蜡包埋(FFPE)样本,进行LFQ蛋白质组学检测。
04.
实验设计
Experimental Design
本文的研究思路:首先使用LFQ定量蛋白质组学分析检测239例上皮性卵巢癌(EOC)样本(分组见上文描述),然后根据蛋白质组学数据进行差异表达分析,发现EOC的组织学亚型之间存在很强的异质性。功能注释富集分析结果揭示了失调的蛋白质和异常的信号通路,并通过构建蛋白质共表达网络发现潜在的预后生物标志物和疾病进展生物标志物。之后利用PRM靶向定量分析来检测这些蛋白以量化其表达水平。最终根据蛋白表达水平、预后价值和成药性确定每种亚型的潜在治疗靶点。
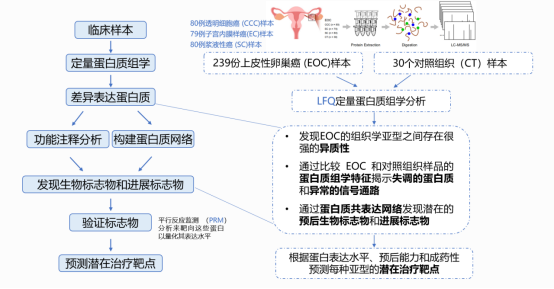
图1 研究流程
05.
实验结果
Experimental Results
(1)
蛋白质组学结果反映EOC临床特征的异质性和差异
研究使用LFQ定量蛋白质组学分析检测239例上皮性卵巢癌(EOC)样本(80例CCC、79例EC、80例SC样本)以及30个对照组织(CT)(图2a)。统一流形近似和投影(UMAP)分析结果显示,肿瘤和非肿瘤样本的蛋白质组以及EOC组织亚型之间存在显著区别(图2b)。为了更好地描述EOC的肿瘤间异质性,研究人员对不同组织亚型患者的临床信息进行了分析,结果显示EC和CCC患者相比, SC患者在诊断时年龄较大,容易复发(图2c)。SC患者多为肿瘤晚期(图2d),生存率显著降低,死亡和复发的风险更高(图2e),通过亚细胞定位分析发现检测到的蛋白质大多来自细胞核、质膜和线粒体(图2f),该结果提示潜在靶标和失调的生物过程可能与这些组分有关。
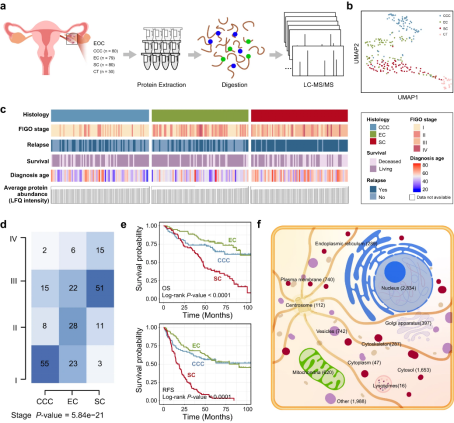
图2 不同EOC组织学亚型的蛋白质组学结果
(2)
失调蛋白影响重要的生物过程
根据蛋白质组数据,与对照组相比,肿瘤样本中分别有295个显著上调蛋白和927个显著下调蛋白(图3a)。对这些差异表达蛋白进行功能注释富集分析,发现大多数失调的蛋白质在肿瘤组织中倾向于下调,且显著富集于细胞死亡、DNA修复/损伤、发育和免疫反应等生物学过程(图3b),并会影响PI3K-Akt、ECM-受体相互作用等通路(图3c)。除此之外,癌症标志的GSEA分析显示,雌激素反应和氧化磷酸化标志蛋白在卵巢癌中表达上调,而凋亡、上皮间充质转化(EMT)、TNF-α信号通路和其他信号通路蛋白在卵巢癌中表达下调(图3d),这表明肿瘤细胞的增殖和转移可能是由这些失调蛋白和途径促进的。
为了区分肿瘤和正常样本,研究者使用差异表达蛋白作为初始特征,然后利用受试者工作特征(ROC)曲线的曲线下面积(AUC)评估了每个特征的分类性能(图3e)。具有鉴别能力的蛋白与外泌体蛋白有重叠的部分(图3e),这些重叠蛋白可能为EOC的研究提供更丰富的视角。
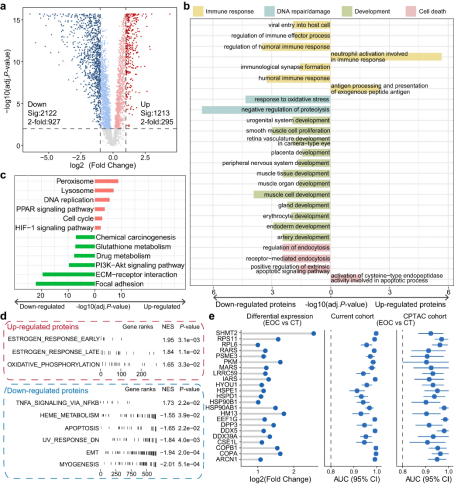
图3 通过蛋白质组学分析确定异常的调控蛋白和通路
(3)
信号通路紊乱提示潜在的治疗机会
由于蛋白质组学分析揭示了几种信号通路的干扰,研究人员接下来试图从多组学角度来阐明这种干扰。他们首先整合先前发表的磷酸化蛋白质组学数据(CPTAC队列)并进行分析,鉴定出在结果2(图3c)所述的途径中的这些蛋白质的磷酸化水平失调(图4a)。
接着通过展示这些途径中蛋白表达热图,以及采用单因素回归分析,评估这些失调蛋白的临床相关性(图4b),发现一些靶点CDK4、CDKN1B和COL1A2在EOC预后的总生存期和无复发生存期中均表现出高风险评分;且细胞外基质受体成员与无复发生存期相关;并使用PRM靶向定量来检测这些蛋白的表达水平,验证其在EOC中仍低表达(图4c),提示靶向这些蛋白可能对未来的临床治疗是有益的。
图4 EOC中信号通路紊乱提示了治疗机会
(4)
蛋白质网络特征可识别候选的生物标志物和进展标志物
为了从蛋白质组学的角度研究队列的生物学特征,研究者使用加权基因共表达网络分析(WGCNA)构建了基于蛋白质表达谱的共表达网络,并对每个模块进行GO注释富集。随后,将各组织学亚型与对照组分别进行比较,来评估这些蛋白的异常表达水平(图5a-c)。有趣的是,Module31的蛋白(图5d)不仅在组织学亚型中存在差异(图5c),而且在晚期(III和IV期)也有高表达,阐明了肿瘤的分子动力学进展(图5e)。特别是在IFIT3表达水平较高的患者中,总生存期明显缩短(图5f),这表明IFIT3可能是EOC的候选生物标志物和进展标志物。
图5 蛋白共表达网络和肿瘤进展标志物
(5)
组织学亚型的不同分子特征和致病机制
为了深入了解不同亚型之间的分子特征,研究者将差异表达蛋白的不同亚型之间进行两两比较,韦恩图显示了EOC不同亚型差异表达蛋白的重叠情况(图6a)。接下来,对这些亚型特异性蛋白进行了功能富集分析(图6b),并利用Metascape通路分析,探讨了通路的生物学意义(图6c)。结果显示,三种亚型的特异性蛋白都在与Rho GTPases相关的信号通路中富集(图6d),但该途径中的蛋白在这三种亚型中均存在差异表达。这些结果表明EOC的不同组织学亚型具有不同的分子特征和致病机制。
图6 亚型特异性蛋白的比较和鉴定
(6)
不同组织学亚型的潜在治疗靶点
接下来研究人员试图为每种组织学亚型寻找潜在的药物靶点,通过将EOC与对照组织相比差异表达的蛋白与亚型特异性蛋白的交集作为候选蛋白,根据Kaplan-Meier曲线和Cox回归分析,确定每种组织学亚型独立且显著的预后蛋白: CSPG4、TMEM87A、MMP7(图7a-f)。
基于MPP7的预后价值和SC的恶性程度,研究者在体外研究了MPP7在SC细胞中的功能,通过细胞周期分布、细胞凋亡、细胞增殖、细胞迁移和细胞侵袭等实验,揭示了MPP7在SC细胞中的生物学功能(图7g-j),并可进一步将这些亚型特异性蛋白作为潜在治疗靶点,进行分析。
图7 不同组织学亚型的潜在治疗靶点
06.
结论
Conclusion
本研究通过对临床样本进行定量蛋白质组学分析,突出了上皮性卵巢癌(EOC)不同组织学亚型临床特征的异质性和差异,揭示了CCC、EC、SC具有显著差异的临床特征、蛋白表达模式和信号通路紊乱,并通过蛋白质共表达网络发现了潜在的预后、疾病进展生物标志物,最后根据不同分子特征和致病机制预测了每种亚型的潜在治疗靶点,推断MPP7蛋白是SC的潜在治疗靶点,其生物学功能在SC细胞中得到证实。该研究为EOC的生物学特性、临床诊断和治疗提供了广泛的见解。
07.
总结
Preface
本文通过对不同的上皮性卵巢癌组织学亚型进行蛋白质组学分析,将蛋白质组学数据、临床信息和体外实验结合,为上皮性卵巢癌的生物学表征、临床诊断和治疗提供了新的视角。
本文的独特之处在于:通过蛋白质组学分析充分探究了上皮性卵巢癌不同组织学亚型的分子特征和治疗靶点。基于组织学亚型的蛋白质丰度、预后情况的显著差异,预测了潜在的预后生物标志物、疾病进展标志物和潜在靶点并通过细胞实验进行了验证,为揭示上皮性卵巢癌不同组织学亚型的分子机制以及制定治疗策略提供了宝贵的资源。
但本文也存在一些局限性:比如历史流行病学数据表明,卵巢癌的发病率和生存率取决于种族和地理区域,研究只包括了来自中国的患者,不能代表整个人群。以及研究蛋白质及其翻译后修饰在信号通路中的重要作用时,整合的CPTAC的磷酸化蛋白质组学数据存在患者种族差异(本文研究中的患者是黄种人,而CPTAC患者主要是白种人),需要进一步的研究来确认本文的研究结果具有临床意义。
文献原文:
Gong TT, Guo S, Liu FH, et al. Proteomic characterization of epithelial ovarian cancer delineates molecular signatures and therapeutic targets in distinct histological subtypes. Nat Commun. 2023;14(1):7802. Published 2023 Nov 28. doi:10.1038/s41467-023-43282-3.