期刊名称:Journal of Ginseng Research
影响因子:6.8
期刊分区:JCR 1区/中科院2区
发表时间:2024年2月
作者单位:福建医科大学、福建农林大学
相关疾病:心肌缺血
样本类型:心肌细胞
相关产品:中药靶点及作用机制研究一站式解决方案
其他信息:网络药理学、分子对接、细胞/动物模型
01
前言
中药凭借其多组分、多靶点的独特优势备受关注,然而,其物质基础不明确、作用机制不清晰等问题,也一直是制约相关研究发展的核心瓶颈。近年来,纯分析类的网络药理学研究不断涌现,但此类研究在认可度、文章发表以及验证可靠性等方面存在诸多不足,且缺乏课题的延续性,导致高分文章的发表难度日益增加。那么,在这种形势下,如何设计中药靶点及机制研究,才能突破瓶颈,发表高影响因子的文章呢?事实上,成功的关键在于将网络药理学、分子对接等生物信息学分析手段与高通量组学技术相结合,这种整合策略能够为中药研究提供更为全面、可信的证据,从而提升研究质量与学术影响力。
今天给大家分享一篇通过结合网络药理学+定量蛋白质组学的分析方法揭示人参皂苷Rg1抗心肌缺血(MI)的潜在靶点及作用机制的文章。该文章于2024年2月发表在《Journal of Ginseng Research》(IF=6.8)杂志上,标题为“Integration of virtual screening and proteomics reveals potential targets and pathways for ginsenoside Rg1 against myocardial ischemia”。
02
研究背景
心肌缺血(MI,myocardial ischemia)是一种病理生理状态,主要由冠状动脉狭窄、痉挛或栓塞等情况导致的心脏供血供氧不足所引起。冠心病、心律失常等疾病患者是心肌缺血的高危人群。心肌缺血的治疗主要以改善心肌供血、减轻心肌耗氧量为目标,通常采用药物治疗。近年来,中医药作为防治心血管疾病的重要资源,在心肌梗死治疗领域展现出巨大的发展潜力。人参皂苷Rg1作为中药人参及三七的主要活性成分之一,已被证实对心血管系统具有保护作用,包括抗心肌缺血再灌注损伤、抑制细胞凋亡以及促进心肌血管生成等,是一种潜在的心血管疾病治疗药物。然而,Rg1对心血管系统的保护机制尚未完全明确,仍需深入研究。
03
研究样本
本研究使用的样本为大鼠心肌细胞H9c2,实验分为正常培养心肌细胞组(对照组)、H2O2诱导损伤组(模型组)、人参皂苷Rg1组(治疗组)。
04
研究思路
本研究采用以下研究思路:首先,基于网络药理学构建了人参皂苷(Rg1)的药物成分-靶点-疾病网络;并对潜在靶点进行富集分析,预测Rg1抗心肌缺血(MI)的靶点蛋白和相关通路;接着,通过分子对接鉴定了两种人参皂苷Rg1对心肌缺血(MI)具有更有利结合活性的靶蛋白,包括丝裂原活化蛋白激酶1(MAPK1)和腺苷激酶(ADK);随后使用TMT定量蛋白质组学,筛选Rg1干预H2O2诱导的心肌细胞损伤模型的差异表达蛋白(DEPs);最后通过动物/细胞实验验证,利用Western blots、蛋白重组和光谱分析(紫外可见光谱和荧光光谱)等技术,进一步证明腺苷激酶(ADK)为Rg1结合和调节氧化磷酸化途径的靶点(如Figure.1)。
Figure.1 研究流程
05
实验结果
(1)Rg1潜在靶点和途径的虚拟筛选
本研究首先获取了Rg1干预心肌缺血的靶点信息(Rg1的化学结构见Figure.2A),并利用Cytoscape软件构建了“Rg1-靶点-疾病”网络(Figure.2B)。网络中,V形节点代表人参皂苷Rg1,菱形节点代表各种疾病,圆形节点代表与疾病相关的潜在靶基因。进一步构建了“蛋白质-蛋白质相互作用(PPI)”网络(Figure.2C),并根据度值分析网络中的关键靶点。随后,对这些潜在靶点进行了GO、KEGG、DO富集分析(Figure.2D-F)。结果显示,氧化应激、活性氧和MAP激酶活性是Rg1抗心血管疾病的重要相关通路,表明氧化应激损伤模型适用于研究Rg1抗心血管疾病的作用机制。
Figure.2 Rg1潜在靶点及其富集分析
(2)Rg1与相关蛋白的分子对接结果
研究者利用Sybyl 1.3和AutoDock Vina提供的指数、总评分和结合能,评估了虚拟筛选中Rg1与121个交叉靶蛋白的结合情况。以总评分>5.0和结合能≤−7 kcal/mol作为筛选标准,共获得PAH、MAPK1、DAPK1、MMP8、PYGL、ADK等19个蛋白可能与Rg1具有结合活性(Figure.3A)。对接结果显示PAH、CFB、MAPK1和ADK这四种蛋白与Rg1的结合构象最为稳定,表明这些蛋白可能是Rg1的潜在结合靶点(Figure.3B)。
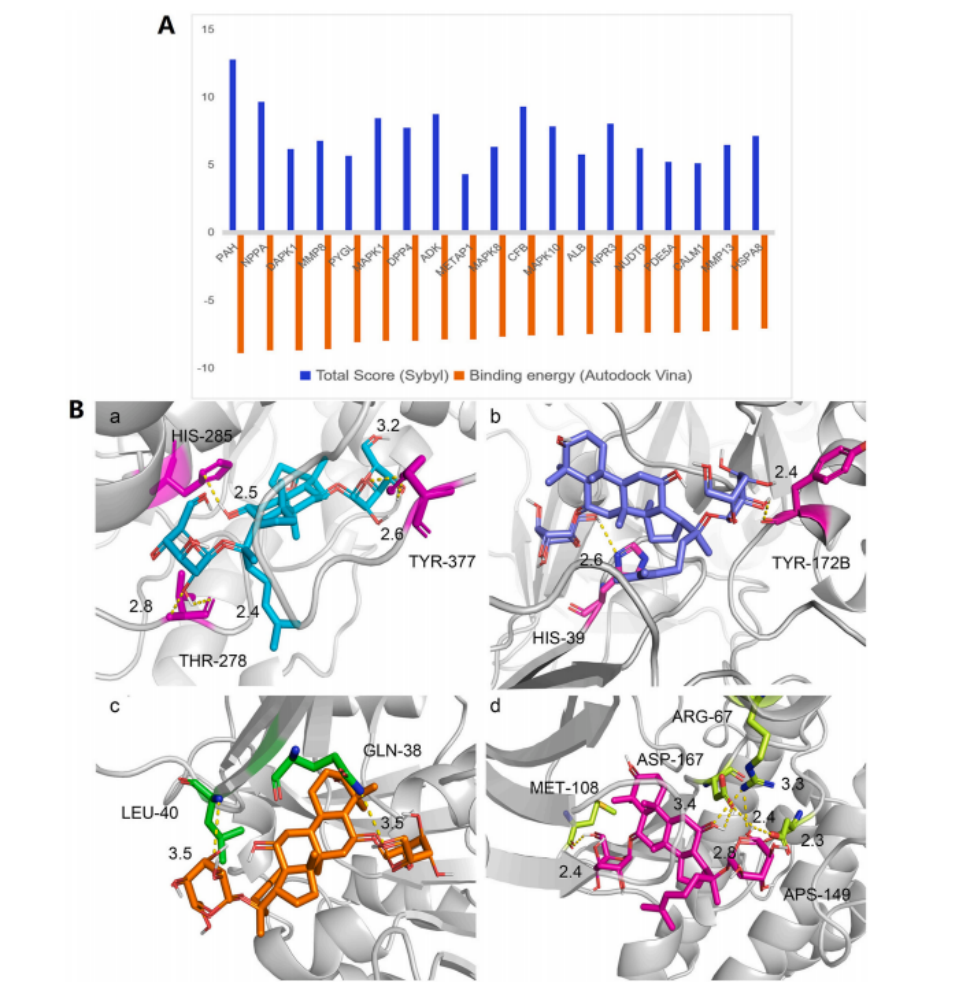
Figure.3 基于Rg1蛋白结构的相互作用预测
(3)Rg1对H2O2诱导的心肌细胞损伤的保护作用及定量蛋白质组学研究
基于虚拟筛选的结果,研究者采用了H2O2诱导的心肌细胞氧化损伤模型。实验结果显示,随着H2O2浓度的增加,细胞活力逐渐降低(Figure.4A-a),表明氧化应激损伤模型构建成功。随后,研究者检测了Rg1对正常培养的H9c2细胞毒性影响,使用浓度梯度的Rg1溶液(6.25、12.5、25、50、100和200μM)处理H9c2细胞(大鼠心肌细胞)24h,检测细胞活力。结果表明,在此浓度范围内,Rg1对H9c2细胞的生长无明显影响(Figure.4A-b)。且后续实验表明,Rg1对H2O2诱导的心肌细胞损伤具有保护作用(Figure.4A-c)。通过质谱分析,共鉴定出5522个蛋白,其中4025个蛋白可用于定量分析(Figure.4B)。以差异倍数=1.3、p值<0.05为筛选标准进行差异分析(Figure.4C),火山图结果表明,Rg1处理可显著改变受H2O2干扰的心肌细胞中蛋白质的表达,提示其对细胞具有保护作用。进一步分析差异表达蛋白的亚细胞定位,发现各组间细胞质、细胞核和线粒体中存在大量差异蛋白,表明H2O2对心肌细胞的损伤机制以及Rg1对心肌缺血的保护机制可能涉及心肌细胞中细胞质、细胞核和线粒体的功能变化。
Figure.4 细胞毒性测试与定量蛋白组学
(4)差异表达蛋白的富集分析
研究者对组间的差异表达蛋白进行了富集分析。KEGG通路富集分析结果显示,Rg1主要通过氧化磷酸化(OXPHOS)、帕金森和阿尔茨海默病、柠檬酸循环(TCA)等信号通路发挥多靶点、多途径的抗心肌缺血作用(Figure.5)。
Figure.5 TMT定量蛋白质组学的DEPs的KEGG富集分析
(5)Rg1干预对MAPK关键蛋白和氧化磷酸化途径的影响及Rg1对ADK的光谱性质
MAPK1/ERK2和MAPK3/ERK1作为两个MAPKs在MAPK/ERK级联中发挥重要作用。本研究通过虚拟筛选和蛋白质组学分析,确认MAPK1为Rg1干预心肌缺血的关键靶点,并在蛋白水平上进行了验证。结果显示,ERK蛋白及磷酸化水平呈Rg1浓度依赖性降低。在OXPHOS通路中,Rg1主要抑制复合物I(NDUFS1)和复合物III亚基(UQCRC2)的表达,同时促进复合物II(SDHB)的表达,从而降低H2O2诱导的氧化应激(Figure.5A)。此外,研究者通过紫外可见吸收光谱和荧光光谱法分析了Rg1与腺苷激酶(ADK)的相互作用。结果显示,在不同浓度的Rg1存在下,ADK的紫外吸收强度和荧光强度均发生变化,表明ADK的确可以与Rg1相互作用(Figure.6B)。
Figure.6 Rg1降低了MAPK和氧化磷酸化途径的磷酸化和激活及ADK与不同浓度Rg1的相互作用
06
结论
这篇文章采用网络药理学+定量蛋白质组学+体外实验验证的方法,揭示了人参皂苷Rg1通过靶向MAPK1和ADK,抑制氧化磷酸化(OXPHOS)通路,有效减轻心肌细胞氧化应激损伤的作用机制。该研究为Rg1的临床应用提供了科学依据,并为其他天然活性成分的作用靶点和途径研究提供了方法学参考。
07
总结
文章使用的实验方法有:网络药理学、富集分析、分子对接、定量蛋白质组学、动物/细胞实验验证等。我司全新推出的中药靶点及作用机制研究一站式解决方案全面整合了前四项方法,并在筛选药物靶点和疾病靶点的过程中,运用高通量组学技术,实现了潜在药物靶点的高效筛选。
中药靶点及作用机制研究一站式解决方案采用“高通量筛选+生物信息学挖掘+关键信号通路验证”的经典研究范式,在客户提供样本后1个月内即可交付实验数据和项目报告。报告内容覆盖中科院2区文章(2024年最新见刊标准)90%工作量,高效筛选,实现精准定位,构建多维网络。助力中药领域的基础研究者获得真实一手数据,深入探究药物机制,发高水平文章!
以上就是今天分享的文章内容,如有任何疑问,欢迎随时与我们联系!如果您计划开展蛋白质组学研究,我们可为您提供全流程的服务,涵盖选题确立、方案设计、样本检测、报告生成以及协助论文发表等关键环节。谱度众合致力于简化科研流程,为您提供全程科研服务,助您摆脱繁琐操作和耗时任务,为您的科研保驾护航!
文献原文:
Xie R, Li C, Zhong C, et al. Integration of virtual screening and proteomics reveals potential targets and pathways for ginsenoside Rg1 against myocardial ischemia. J Ginseng Res. 2024;48(4):395-404. doi:10.1016/j.jgr.2024.02.001IF: 6.8 Q1
撰写人:李鑫
审核人:肖宇琴