01
产品简介
本公司SpecAlly 开发的中药靶点及作用机制研究一站式解决方案,采用“高通量筛选+生物信息学挖掘+关键信号通路验证”的经典研究范式。该方案通过高通量的药物靶点筛选、疾病靶点筛选、治疗靶点筛选实验,结合多个数据库构建“药物-成分-靶点-疾病” 多维网络,实现潜在药物靶点的高效筛选和相关作用机制的深入探究。
本一站式解决方案提供完整的结题报告,内容覆盖中科院2区文章(2024年最新见刊标准)90%工作量。报告内容涵盖高质量的质谱数据、丰富的生物信息学分析图表、核心结果组图、中英文对照的方法学文案。我们会在客户提供样本后 1个月内交付实验数据和项目报告,为您的研究提供全面、高效的技术支持,快速推进研究进程。
02
技术背景
药物靶点筛选技术
药物靶点筛选采用有限蛋白水解质谱技术(Limited Proteolysis Mass Spectrometry,LiP-MS)。该技术基于有限水解原理识别药物作用的蛋白靶点。具体而言,在生理状态下,蛋白质的动态变化会暴露其表面肽段的酶切位点。当药物与靶蛋白结合后,会在整体或局部水平上稳定蛋白质结构,从而大大降低蛋白表面肽段暴露和被蛋白酶酶切的可能性(图1)。
图1 LiP-MS原理:小分子配体(药物)稳定蛋白结构
基于上述理论,设置药物处理的实验组与溶剂处理的对照组,再使用非特异性的蛋白酶进行处理。由于药物与靶蛋白的结合会改变蛋白质的局部酶切模式,在药物结合的靶蛋白上会形成酶切位点(肽段)的差异。随后,通过质谱技术来定量筛选出组间差异的肽段(蛋白),从而可以确定药物作用的结合靶点(图2)。
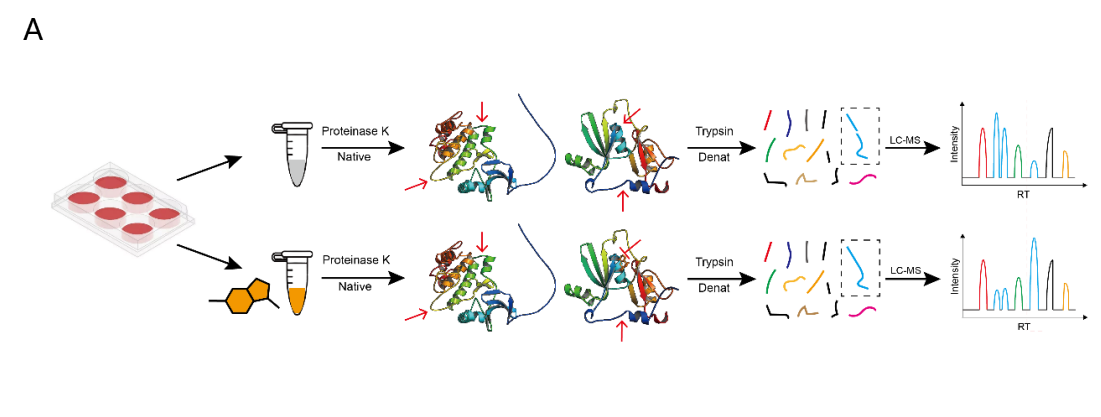
图2 LiP-MS流程图
疾病和治疗靶点筛选技术
通过高分辨、高灵敏的质谱技术,能够全面无偏见地测定生物体内蛋白质的丰度及其动态变化,为疾病和治疗靶点的研究提供坚实的数据基础。
本解决方案中共设置三个检测组:对照组、疾病造模组及疾病造模给药组。样本类型不限血液、细胞或患病组织,从原始样品中提取蛋白质后,进行酶解和除盐处理,随后用高分辨液质联用系统进行检测。基于质谱检测数据,可以比较不同组间的蛋白质组定量差异,从而筛选出差异表达的蛋白质。例如,疾病组与对照组间的差异蛋白可能是潜在的疾病靶点,而给药组与疾病组间的差异蛋白即为潜在的治疗靶点(图3)。进一步结合生物信息学分析,可以揭示不同组间差异的分子机制,提示与关键药物作用相关的信号通路。
图3 疾病和治疗靶点筛选流程图
03
实验设计
技术路线
本产品基于质谱无偏见数据,直接筛选药物靶点、疾病靶点和治疗靶点,并挖掘丰富的数据库信息,构建“药物-成分-靶点-疾病”的多维网络,随后对这些潜在靶点进行功能富集分析,并对关键活性成分和核心靶点进行分子对接,最后可以通过动物细胞实验对关键靶点及通路进行验证,形成完整的中药靶点及作用机制研究文章。
完整版报告包含7大分析模块,25+项分析内容,最终交付4组核心组图(详情如下图所示),结题报告即可以独立成文。
04
产品优势
保障阳性结果
结果图表丰富
快速发文
一站式服务
杂志接受度高
无科研诚信风险
05
报告结果实例
1.药物基本信息总览
借助中药系统药理学数据库和分析平台(TCMSP),筛选出所研究中药的活性成分(A),并通过各类生物信息学数据库,如 SwissTargetPrediction等,收集与中药活性成分相关的蛋白质信息,并预测潜在的作用靶点,绘制药物-成分-靶点网络图(B)。
本结果可用于获取药物成分信息,初步从数据库获得药物的成分及对应靶点。
2.药物靶点
采用限制性酶解-质谱分析技术(LiP-MS)(A),在体外非变性条件下,从疾病模型细胞/组织中提取全部蛋白,分别使用中药药物和溶剂进行处理,随后进行有限水解实验和质谱高通量的数据采集,通过火山图和定量热图筛选出两组间的差异肽段,从而在整体蛋白水平筛选出药物作用的直接结合靶点(B、C)。接着从数据库中检索差异蛋白中的转录因子、激酶、离子通道、受体和已知的药物靶点等重要功能蛋白(D),更新质谱数据与数据库联合分析的药物-成分-靶点网络图(E),并给出推荐的蛋白靶标列表(F)。
本结果展示了LiP-MS实验筛选的结合靶点和药物靶点数据库联合分析获取的药物潜在靶点。
3.疾病靶点
通过疾病组/对照组的差异倍数和P值筛选组间显著差异蛋白,并通过火山图以及热图(A、B),综合展示差异蛋白的表达情况及样本之间的差异情况。对差异蛋白进行富集分析,展示差异蛋白所属KEGG重要信号通路及GSEA富集通路等信息(C、D)。并通过差异蛋白与疾病靶点数据库(TTD、OMIM、Gene cards)联合分析,获取疾病靶点(E)。
本结果用于展示疾病模型高通量筛选的差异蛋白与疾病靶点数据库联合分析而获取的疾病靶点信息,同时作为后续构建生物信息网络的基础。
4.治疗靶点
基于疾病造模组+给药组/疾病造模组的差异倍数和p值筛选组间显著差异蛋白绘制火山图(A),对差异蛋白进行富集分析,展示差异蛋白所属重要信号通路信息(B),联合第3部分疾病造模组的数据分析蛋白靶点在对照、疾病、治疗组中的动态变化,并将表达模式相近的通过Mfuzz聚类图展示出来(C),最终将治疗靶点与前面结果中的药物靶点、疾病靶点取交集获得潜在的药物治疗疾病靶点(D)。
本结果用于展示药物处理高通量筛选差异蛋白作为潜在治疗靶点,并联合药物靶点、疾病靶点取交集精准缩小药物治疗疾病靶点的范围。
5.互作网络分析
参考系统生物学研究思路,构建药物-成分-靶点-疾病网络(A、B)。将已确定的药物活性成分、作用靶点以及疾病相关信息整合到一个网络体系中,通过网络拓扑分析等技术,找出网络中的关键节点,即核心活性成分和关键靶点。
本结果用于展示药物-成分-靶点-疾病网络,揭示药物主要活性成分和药理作用的系统网络机制,后续可挑选排名靠前的活性成分和关键靶点,开展进一步研究验证。
6.功能富集分析
借助基因本体论(GO)和京都基因与基因组百科全书(KEGG)等功能数据库和富集分析算法,确定靶点在细胞内的生物学过程、分子功能以及参与的信号通路(A-D)。
本结果用于展示药物治疗疾病影响的特定信号通路,揭示药物治疗疾病可能存在的分子机制(通路)。
7.分子对接
研究核心靶点与排名靠前的3种药物关键活性成分之间的相互作用,计算主要活性成分与核心靶点的结合亲和力,得到分子对接结合能(A),结合能(kcal/mol)小于-5时表明蛋白质与活性成分具有良好的结合活性,并进行分子对接结果的结构可视化(B)。
本结果用于展示药物治疗疾病的具体靶点信息,精确到氨基酸位点,并预测小分子与特定靶点的亲和力,这对于理解药物的作用机制和药代动力学性质至关重要。
06
项目准备
1、确认研究药物及疾病;
2、选择实验体系是临床样本、模式动物还是细胞;
3、选择研究的具体样本类型。
准备实验材料
野生型对照组:3只/皿未经处理的动物/细胞;疾病模型组:6只/皿研究疾病造模的动物/细胞;给药治疗组:3只/皿疾病造模后给药的动物/细胞;分别在疾病模型特征出现和治疗疗效出现后选择合适时机收集研究的器官或细胞。
注:动物/细胞上没有出现治疗疗效,但临床上有疗效证据也可以。通常建议细胞样本每组至少3个重复,动物样本每组至少5个重复,临床样本每组至少10个重复。
送样要求
按照分组每个样本提供不少于:组织:100 mg组织;细胞:1个10 cm皿(10^7)细胞;血浆:100 uL。提供中药汤剂上清不少于1 mL;(以上为常规样本量需求,若样本量可能不足需根据具体情况出专属方案)。建议所有样本保留额外备份,用于可能的WB/ELISA等验证实验。
07
总结
中药靶点及作用机制研究一站式解决方案,是谱度众合公司针对中药研究领域的研究者原创性开发的一站式解决方案。产品整合程度高,报告结果非常贴近论文发表标准,客户仅需提供临床或动物细胞模型样本及药物,即可一次性完成中科院2区文章90%工作量(3区文章全部工作量)。此外,每个项目将同时配套资深的学术顾问和生信专家,为您的科研成果发表保驾护航。
谱度众合是一家由武汉大学博士团队创办的科研服务企业,我们专注于利用质谱技术服务于生物标志物、药物靶点筛选、基础研究等蛋白质研究领域,我们在本专业细分领域持续深耕十几年,针对具体研究场景开发多种面向具体研究目的和论文发表需求的服务产品,助力客户更轻松更高效地完成科研目标。
参考文献
[1] Guo, B., Zhao, C., Zhang, C., Xiao, Y., Yan, G., Liu, L., & Pan, H. (2022). Elucidation of the anti-inflammatory mechanism of Er Miao San by integrative approach of network pharmacology and experimental verification. Pharmacological research, 175, 106000.
[2] Yuan, Y., Sheng, P., Ma, B., Xue, B., Shen, M., Zhang, L., Li, D., Hou, J., Ren, J., Liu, J., Yan, B. C., & Jiang, Y. (2023). Elucidation of the mechanism of Yiqi Tongluo Granule against cerebral ischemia/reperfusion injury based on a combined strategy of network pharmacology, multi-omics and molecular biology. Phytomedicine : international journal of phytotherapy and phytopharmacology, 118, 154934.
[3] Shang, L., Wang, Y., Li, J., Zhou, F., Xiao, K., Liu, Y., Zhang, M., Wang, S., & Yang, S. (2023). Mechanism of Sijunzi Decoction in the treatment of colorectal cancer based on network pharmacology and experimental validation. Journal of ethnopharmacology, 302(Pt A), 115876.
[4] Xin, P., Xu, X., Zhang, H., Hu, Y., Deng, C., Sun, S., Liu, S., Zhou, X., Ma, H., & Li, X. (2023). Mechanism investigation of Duhuo Jisheng pill against rheumatoid arthritis based on a strategy for the integration of network pharmacology, molecular docking and in vivo experimental verification. Pharmaceutical biology, 61(1), 1431–1445.
[5] Xia, X., Zeng, H., Wang, H., Li, X., Zhang, S., Yang, L., & He, J. (2023). Revealing the Active Constituents and Mechanisms of Semiliquidambar cathayensis Chang Roots against Rheumatoid Arthritis through Network Pharmacology, Molecular Docking, and in Vivo Experiment. Chemistry & biodiversity, 20(1), e202200916.